《四川省雅安市雨城區(qū)中里鎮(zhèn)中學(xué)九年級(jí)化學(xué)下冊(cè) 9.2 溶解度(第1課時(shí))學(xué)案(無(wú)答案)(新版)新人教版》由會(huì)員分享,可在線閱讀���,更多相關(guān)《四川省雅安市雨城區(qū)中里鎮(zhèn)中學(xué)九年級(jí)化學(xué)下冊(cè) 9.2 溶解度(第1課時(shí))學(xué)案(無(wú)答案)(新版)新人教版(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�����。
1�����、溶解度
學(xué)習(xí)目標(biāo)
通過(guò)實(shí)驗(yàn)探究�����,建立飽和溶液與不飽和溶液的概念����,了解飽和溶液與不飽和溶液的相互轉(zhuǎn)化的方法,了解結(jié)晶現(xiàn)象�。
初步培養(yǎng)活動(dòng)與探究的一般程序:提出問(wèn)題→建立假設(shè)→設(shè)計(jì)方案(畫出實(shí)驗(yàn)簡(jiǎn)圖)→動(dòng)手實(shí)驗(yàn)→觀察記錄→分析現(xiàn)象→得出結(jié)論。
通過(guò)實(shí)驗(yàn)條件的改變�,讓學(xué)生感受飽和溶液與不飽和溶液的存在和轉(zhuǎn)化是有條件的�����,逐步建立用辯證的�����、發(fā)展的思想觀點(diǎn)來(lái)看待事物的變化���,和逐步培養(yǎng)由具體到一般認(rèn)識(shí)事物過(guò)程的能力�����,并培養(yǎng)學(xué)生互相協(xié)作���、友好相處的健康心態(tài)。
重點(diǎn)和難點(diǎn)
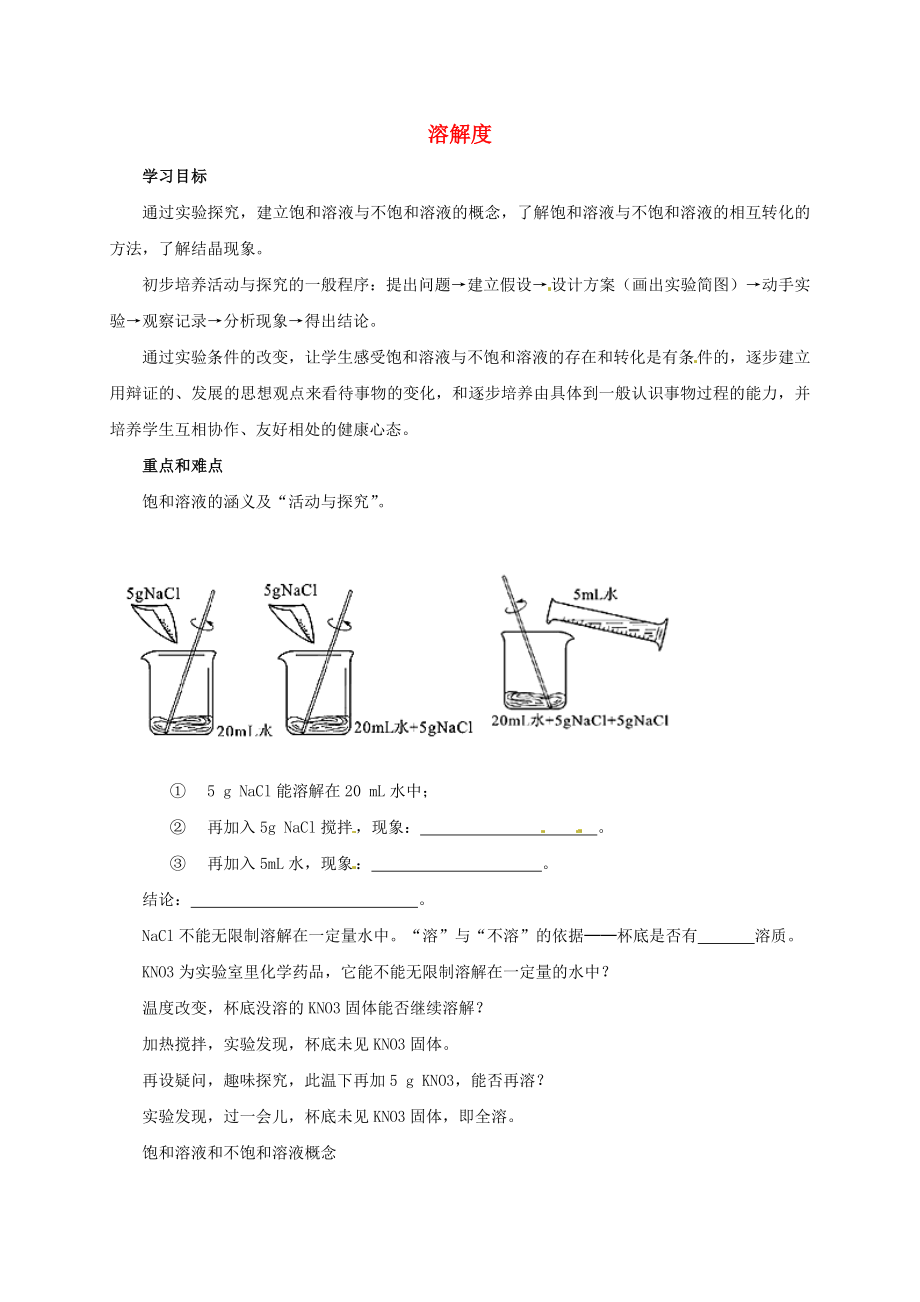
飽和溶液的涵義及“活動(dòng)與探究”�����。
① 5 g NaCl能溶解在20 mL水中;
② 再加入5g
2�、NaCl攪拌,現(xiàn)象: ����。
③ 再加入5mL水,現(xiàn)象: �����。
結(jié)論: ����。
NaCl不能無(wú)限制溶解在一定量水中?!叭堋迸c“不溶”的依據(jù)──杯底是否有 溶質(zhì)。
KNO3為實(shí)驗(yàn)室里化學(xué)藥品��,它能不能無(wú)限制溶解在一定量的水中����?
溫度改變,杯底沒(méi)溶的KNO3固體能否繼續(xù)溶解�?
加熱攪拌,實(shí)驗(yàn)發(fā)現(xiàn)����,杯底未見(jiàn)KNO3固體�����。
再設(shè)疑問(wèn)�����,趣味探究,此溫下再加5 g KNO3�����,能否再溶��?
實(shí)驗(yàn)發(fā)現(xiàn)�����,過(guò)一會(huì)兒�,杯底未見(jiàn)KNO3固體,即全溶��。
飽和溶液和不飽和
3�����、溶液概念
在 下,向 溶劑里加入某種溶質(zhì)��,當(dāng)溶質(zhì) 溶解時(shí)���,所得的溶液叫做飽和溶液���, 溶解的溶液叫做不飽和溶液。
室溫�����,5 g NaCl在20 mL水中得不飽和溶液
↓+5 g NaCl
室溫��,10 g NaCl在20 mL水中得到飽和溶液和少許NaCl固體
↓+5 mL水
室溫����,10 g NaCl在25 mL水中得到不飽和溶液
室溫,5 g KNO3在20 mL水中得不飽和溶液
↓+5 g KNO3
室溫��,10 g KNO3在20 mL水中得到飽和溶液和少許KNO3固體
↓升高溫度
升高溫度下�,10 g
4、 KNO3在20 mL水中得到不飽和溶液 ?
分析歸納��,課件演示
飽和溶液二要素:“一定溫度下”“一定量的溶劑”。
室溫下�,10 g KNO3在20 mL水中溶液達(dá)到飽和,升高溫度���,杯底KNO3固體繼續(xù)溶解�����,且又溶解了5 g KNO3����;冷卻到室溫���,20 mL水溶解KNO3的質(zhì)量不超過(guò)10 g,此時(shí)多余的KNO3會(huì)怎樣���?
從海水里提取食鹽的過(guò)程
粗鹽------溶于水過(guò)濾----濾渣
濾液--試劑1過(guò)濾-----白色沉淀A
濾液-----------試劑2過(guò)濾---白色沉淀B
濾液---操作M---------NaCI
1) 試劑1是一種可溶性堿���,那么白色沉淀
5、A是__________,試劑2是___________.
2)加入試劑1.2分別發(fā)生兩個(gè)反應(yīng)的化學(xué)方程式是_____________________________________.
3)操作M的名稱是____________________.
提取的方法是將海水引入海灘上的鹽田里���,利用日光和風(fēng)力逐漸使水蒸發(fā)�,慢慢濃縮,使食鹽呈結(jié)晶析出從鹽鹵中提取氯化鉀曬鹽后剩下的鹽鹵中含有氯化鉀�����、氯化鎂�����,還含有少量氯化鈉��??衫萌N物質(zhì)溶解度的不同將它們分離開(kāi)來(lái)。分析三種物質(zhì)的溶解度可知��,室溫(20℃)時(shí)���,氯化鎂的溶解度(54.3克)大于氯化鉀和氯化 鈉的溶解度��。因此���,在室溫時(shí)向混合物中加適量水,就可將大部分氯化鎂溶解在水中�����,從而可分離除去氯化鎂。然后根據(jù)在27℃以下氯化鉀的溶解度小于氯化鈉的溶解度的特點(diǎn)�,向剩余的混合物中第二次加適量水,就可將氯化 鈉溶解于水����,從而得到氯化鉀粗品。將粗品氯化鉀進(jìn)一步進(jìn)行結(jié)晶和重結(jié)晶����, 可得到精制的氯化鉀。
 四川省雅安市雨城區(qū)中里鎮(zhèn)中學(xué)九年級(jí)化學(xué)下冊(cè) 9.2 溶解度(第1課時(shí))學(xué)案(無(wú)答案)(新版)新人教版
四川省雅安市雨城區(qū)中里鎮(zhèn)中學(xué)九年級(jí)化學(xué)下冊(cè) 9.2 溶解度(第1課時(shí))學(xué)案(無(wú)答案)(新版)新人教版